צריבה – אבלציה
טכנולוגיות מתקדמות בשרות האבלציות המורכבות
עברו כבר יותר מ-25 שנים מאז שהחלו להשתמש באבלציה (צריבה = Ablation) כטיפול יעיל ובטוח יחסית להפרעות קצב לב. בתחילה הדבר נעשה ע"י שימוש בזרם ישר ובהמשך ע"י גלי רדיו שעד היום מהווה כאמצעי הנפוץ ביותר לצריבה כטיפול בהפרעות קצב לב. בהמשך התפתחו טכניקות נוספות של צריבה ע"י הקפאה (Cryoablation), שימוש בליזר, אולטרסאונד, גלי מיקרו ועוד.
בנוסף לאמצעי האבלציה השונים השתכללו גם טכניקות המיפוי של הפרעות קצב הלב והבנת מנגנוני התפתחות הפרעות קצב מורכבות. כל זה הביא לשיפור ביכולת לטפל באופן יעיל גם בהפרעות קצב לב מורכבות יותר.
בעבר טופלו בעיקר הפרעות קצב יחסית פשוטות לצריבה, אך היום ניתן לטפל בהפרעות קצב מורכבות יותר כמו ריפרוף פרוזדורים לא טיפוסי, פירפור פרוזדורים וטכיקרידה חדרית. הפרעות קצב אלו קשורות לעיתים עם מחלה סטרוקטוראלית (מבנית) משמעותית של הלב כמו: פגמים מולדים, לאחר אוטמים בשריר הלב או לאחר ניתוחים בלב.
על מנת לטפל באותם הפרעות קצב מורכבות פותחו מספר מערכות מיפוי (Electroanatomic mapping = EAM) המאפשרות לרופא לרשום פעילות חשמלית תוך לבבית מקומית ביחס למיקום אנטומי – תלת מימדי – בתוך חלל הלב או בחלקו החיצוני, בזמן הפרעת הקצב. טכנולוגיות אלו מאפשרות לאתר באופן מדויק את מוקד הפרעת הקצב, להגדיר באופן תלת מימדי את האזור בלב שממנו מגיעה הפרעת הקצב, ולאפשר מניפולציה של קטטר האבלציה ולציין את מיקומו בצורה מדויקת וללא צורך בשיקוף ושימוש בקרינת רנטגן.
מערכות אלו מפשטות את שלב המיפוי ומעלות את אחוז הצלחת הפעולה במיוחד בהפרעות קצב מורכבות הקשורות לאזורים אנטומיים מורכבים.
במערכות למיפוי אלקטרואנטומי תלת מימדי נעזרים כאשר המקור להפרעת הקצב נמצא ליד אזור אנטומי חשוב והחשש הוא מפגיעה באזור חשוב זה בזמן האבלציה ולכן מוסיפה לבטיחות הפעולה.
כמו כן, כאשר הפרעת קצב מורכבת קשורה לאזור צלקתי התורם ליצירה של מעגל חשמלי (Macroreentry) מערכת המיפוי יכולה לעזור ב"חשיפת" אותו אזור צלקתי שמהווה את מקור הפרעת הקצב.
יתרון משמעותי נוסף הוא הירידה בצורך בשימוש בשיקוף וקרינת רנטגן (Fluoroscopy) על מנת לוודא את מיקומו של קטטר האבלציה בצורה מדוייקת – היתרון הוא הן לפציינט והן למפעיל. ואכן מחקרים רבים הראו ירידה משמעותית בזמן השיקוף בפעילות עם מערכות אלו לעומת מיפוי קונבנציונלי.
החיסרון במערכות אלו הוא עלותן היחסית גבוהה והצורך בהכנה נוספת הכרוכה בתפעול המערכות הנ"ל.
מערכת ה-CARTO (Biosense, Diamond Bar, CA, USA) משתמשת בשדה מגנטי בעל עוצמה נמוכה (5 x 10-6 to 5 x 10-5 Tesla) הנוצר בנפרד משלושה סלילים המונחים מתחת למיטת החולה במעין מבנה של משולש עם 3 קודקודים (סלילים). עוצמת השדה המגנטי מכל סליל נמדדת ע"י חישן הנמצא בקצה קטטר המיפוי. עוצמת השדה המגנטי הנוצר מכל סליל היא פרופוציונלית הפוכה למרחק בין החיישן לאותו סליל. מכאן, שע"י אינטגרציה של מרחק קטטר המיפוי מכל אחר מהסלילים (המתורגם מעוצמת השדה המגנטי מכל סליל) ניתן למקם את הקטטר במרחב (תמונה 1).
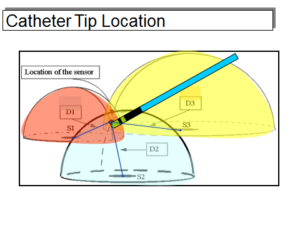
תמונה 1: יצירת 3 שדות אלקטורמגנטיים שונים באמצעות 3 סלילים שונים הנמצאים מתחת למיטת החולה. עוצמת השדה האלקטרומגנטי הנוצר מכל סליל הוא פרופורציונלי הפוך למרחק הקטטר מהסליל. חישתם ע"י קטטר המיפוי באמצעות חיישן שקיים בקצהו מאפשר את חישוב מיקומו של הקטטר במרחב.
קצה הקטטר יכול לגרום לצריבה (אבלציה) באמצעות גלי רדיו (RF).
ניתן להזיז את הקטטר בחלל הלב על מנת לרשום את עוצמת הפעילות החשמלית המקומית, לתזמן אותה ובו בזמן לרשום נקודות ציון במרחב וליצור מבנה גאומטרי תלת מימדי.
מחקרים בבני אדם הצביעו על דיוק מערכת CARTO בכל הנוגע לבנית המודל הגאומטרי התלת מימדי, מפת האקטיבציה(תזמון) של פעילות החשמלית בזמן הפרעת הקצב והדיוק במיקום התלת מימדי ( Spatial precision ).
המערכת יכולה לגם לציין באופן מדויק מבנים אנטומים חשובים שלא נרצה לפגוע בהם בזמן אבלציה.
תמונה מס 2 מדגימה מפת אקטיבציה ( התקדמות הפעילות החשמלית בחלל הלב הנדגם) בזמן הפרעת קצב לב . הצבעים מציינים אזורים בעלי תזמון זהה של פעילות חשמלית – .אדום הוא המוקדם ביותר וסגול המאוחר ביותר ( בהתאם למדרג הצבעים שבפינה הימנית העליונה). הנקודות האדומות מציינות את אזורי הצריבה של מוקד הפרעת הקצב
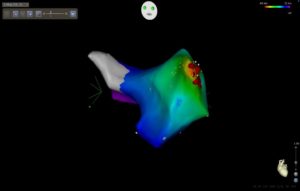
תמונה 2: Activation map של טכיקרדיה עליתית מוקדית ( Focal atrial tachycardia )שמקורה מאזור הקרוב לאוזנית של עליה שמאלית.
ניתן לזהות אזורים צלקתיים ( Scar mapping ) ע"י מעקב אחר האמפליטודה של הפוטנציאל המקומי שבו נמצא הקטטר. באזורים צלקתיים האמפליטודה תהיה נמוכה יותר ביחס לאזורים "בריאים".
החשיבות שביצירת ה- Scar map היא שאזורים צלקתיים מהווים כר ליצירת מעגלי חשמליים Reentry ) ) ולהפרעות קצב חוזרות ולעיתים אף לא יציבות המודינמית ושלכן לא נסבלות ע"י החולה, כך שלא ניתן למפות את הפרעות הקצב בזמן הפרעת הקצב ולכן ישנה חשיבות רבה ליצירת Scar mapping במיוחד במצבים אלו.
CARTO Merge היא אופציה נוספת המאפשרת השלכה של מבנה תלת מימדי שנבנה באמצעות הדמיה ( CT או MRI ) לפני הפעולה על מבנה תלת מימדי שנוצר בזמן אמת ע"י מערכת ה- CARTO כך ששני המבנים התלת מימדיים עוברים מעין מיזוג ( Merging ) – תהליך זה עוזר למפעיל להבין טוב יותר חללים אנטומים מורכבים ( למשל מבנה העליה השמאלית ואזורי החיבור בין ורידי הריאה לעליה שמאלית בזמן אבלציה של פירפור פרוזדורים)
ב- 15 שנים האחרונות חלו גם שינויים במבנה הקטטרים של האבלציה שאיפשרו יצירת לזיות( lesions) עמוקות ונרחבות יותר עם תוצאות טובות יותר ופחות סיבוכים הקשורים לחימום יתר של קצה הקטטר.
הלזיה שנוצרת בזמן הצריבה תלויה בצפיפות האנרגיה או ההספק שמוזרם דרך קצה האלקטרודה. אנרגיה זו גורמת ליצירת חום ברקמה וגם מחממת את קצה הקטטר. במצבים מסוימים עקב התחממות יתר של קצה האלקטרודה לא ניתן להזרים מספיק אנרגיה דרך קצה הקטטר על מנת לגרום לנזק מספיק עמוק ונרחב ברקמה על מנת לטפל בהפרעת הקצב הספציפית.
על מנת לאפשר הזרמת אנרגיה מספקת ויצירת לזיות עמוקות יותר ברקמה פותחו שתי שיטות שבאות לפתור בעיה זו – השיטה הראשונה היא פיתוח אלקטרודות עם שטח מגע גדול יותר ( 8 ו-10 מ"מ לעומת 4 מ"מ בקטטר סטנדרטי) –הדבר מאפשר שטח מגע גדול יותר עם הרקמה ולכן גורם ליצירת לזיות נרחבות יותר וכן לחשיפה גדולה יותר לזרם הדם שתורמת לקירור טוב יותר ע"י הדם של קצה הקטטר.
פיתוח נוסף הוא ה- irrigation catheter שבו דרך קצה הקטטר מוזרמים מים סטרילים באופן מתמיד המקררים את שטח המגע בין קצה הקטטר לרקמה.
שתי שיטות אלו מאפשרות הגברת ההספק המוזרם דרך קצה האלקטרודה ויצירת לזיות עמוקות ונרחבות יותר . כמו כן השימוש ב- irrigation catheter מאפשר לבצע אבלציות באזורים בהם זרימת הדם היא איטית מאד או לא קיימת בכלל ( כמו בחלל הפריקרדיאלי).

אבלציה לפירפור פרוזדורים:
התפתחות רבה ושינויים גדולים התרחשו בעשור האחרון בכל הנושא הקשור לצריבה של פירפור פרוזדורים.
פירפור פרוזדורים הינה הפרעת קצב הלב השכיחה ביותר ושכיחותה הולכת ועולה עם השנים. רק בארה"ב יש קרוב ל- 3 מיליון אנשים הסובלים מפירפור פרוזדורים ושיעור פעולות האבלציה לפירפור פרוזדורים גם הוא הולך וגדל ומשתכלל עם השנים.
תחום זה עבר ועדיין עובר את השינויים הדרמטיים ביותר בתחום האלקטרופיזולוגי. מחקרים רבים מעידים על היעילות הרבה יותר שיש לטיפול ע"י אבלציה לעומת טיפול אנטיארתמי בחולים הסובלים מפירפור פרוזדורים לשמירה על קצב סינוס . כמו כן יש שיפור בתוצאות ובבטיחות הפעולות עם התפתחות השיטות והטכנולוגיות השונות.
פעולות אבלציה בפירפור פרוזדורים הינן מורכבות מאד ודורשות מיומנות רבה .
בבסיס פעולות אלו , מבוצע בידודם החשמלי של ארבעת ורידי הריאה( Pulmonary Veins Isolation= PVI ) ולעיתים יש צורך בצריבות נוספות .
מערכות ניווט אלקטוראנטומיות תלת מימדיות כפי שתוארו מקודם עוזרות לרופא להבין את האנטומיה המורכבת של העליה השמאלית והרידים הראתיים ולמקם בצורה טובה את האזורים שבהם אנו מעונינים לבצע צריבה סביב הורידים הראתיים ללא שימוש בקרינה מייננת.
פיתוח ושימוש ב- Intracardiac echocardiography( ICE) , שהינו קטטר המוחדר דרך הוריד הפמורלי לעליה השמאלית שבקצהו מתמר אולטראסאונד ,גרם לכך שפעולת האבלציה הפכה להיות קלה ובטוחה יותר.
טכנולוגיה נוספת( CartoSound – Biosense Webster, Cincinnati, Ohio)מאפשרת למזג את האינפורמציה האנטומית המתקבלת באמצעות קטטר האולטראסואונד בזמן אמת ומשלבת אותו עם מערכת CARTO למיפוי אלקטרואנטומי תלת מימדי באמצעות חישן מדויק הקיים על קטטר האולטראסואנד.
Balloon-based ablation system
טכנולוגיה נוספת של אבלציה המבוססת על קור ועל קטטר שבקצהו ניתן למלא בלון בנוזל סטרילי לצורך בצוע בידוד של הורידים הראתיים( PVI ).
מערכות אבלציה מבוססות בלון מתאימות עצמן לאנטומיה של הורידים הראתיים דבר המאפשר יצירת אבלציה בהיקף הבלון ובידוד הוריד הראתי במספר מצומצם של אבלציות תוך המנעות מיצירת היצרויות בורידים הראתיים .
מערכות אלו מאפשרות ביתר קלות להשיג את בידודם החשמלי של הורידים הראתיים לעומת המערכות הסטנדרטיות של קטטר המבצע לזיות נקודתיות סביב הוריד הראתי הדורשות מיומנות רבה על מנת להשיג את בידודו של הוריד הראתי.
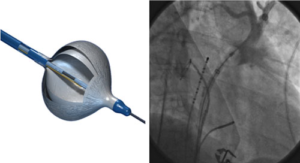
משמאל: ה-Cryoballoon מורכב ממערכת של שני בלונים המורכבים על קטטר 10.5 Fr . מוזרם לתוך הבלון הפנימי חנקן נוזלי קר המתאדה במגע עם חום מהרקמות מסביבו וגורם להתפשטות הבלון. הבלון החצוני מהווה בטחון למניעת זליגה של נוזל החנקן.
מימין: לאחר ניפוח ה-Cryoballoon בפתח הוריד הראתי ,מוזרק חומר ניגוד דרך החלל המרכזי דיסטאלית לבלון על מנת לוודא חסימה מלאה של הוריד הראתי ע"י הבלון.
Force sensing Technologies
מחקרים מראים כי הכוח המופעל על קצה קטטר האבלציה משפיע באופן דרמטי על גודל הלזיה ועל בטיחות הפעולה. כוח מופחת מדי גורם ללזיות קטנות ולא עמוקות גם אם משתמשים באנרגיה גבוהה יחסית ומצד שני במידה ומשתמשים בכוח מפורז גם אם משתמשים באנרגיה יחסית נמוכה ניתן לגרום לחימום יתר של קצה האלקטרודה ולסיבוכים הקשורים לכך כמו פרפורציה ושבץ מוחי.
מחקרים הראו כי למפעיל יש קושי בהערכת מידת הכוח המופעל על קצה הקטטר במגע שלו עם הרקמה ולכן פותחו טכנולוגיות הכוללות חיישנים בתוך הקטטרים היכולים למדוד את הכוח המופעל על קצה הקטטר. מחקרים הראו כי בשימוש בטכנולוגיה זו ניתן ליצור לזיות אפקטיביות יותר לאורך זמן ומפחיתים את הסיבוכים הקשורים להפעלת כוח מופרז על קצה הקטטר.
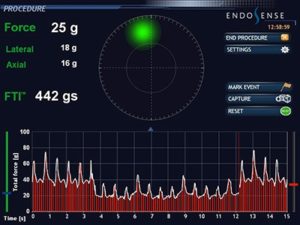
תצוגה של קטטר עם force sensing technology. הכוח הלטרלי והאקסיאלי ביחד עם כח המגע הכללי מוצגים. כמו כן זוית המגע עם הרקמה מוצגת בזמן אמת. למטה הכוח מוצג בצורה גרפית לאורך זמן .
לסיכום:
השתכללות הטכניקות השונות של אבלציה ומיפוי הפרעות הקצב בעשור האחרון הפכו את הטיפול בהפרעות קצב לב באמצעות אבלציה למקובל יותר.
קיימת התפתחות מתמדת בהבנת מנגנוני הפרעות קצב לב ,בטכניקות המיפוי, ובטכנולוגיות השונות לבצוע האבלציה עם שיפור בבטיחות הפעולות ובתוצאות הסופיות לטווח ארוך.
בשנים האחרונות לאור ההתפתחויות המרשימות שחלו בתחום זה ניתן לבצע גם אבלציות להפרעות קצב לב מורכבות מאד .
בחלק גדול מהפרעות קצב לב הטיפול הראשוני( first line therapy ) בהן הוא באמצעות אבלציה ולא תרופתי ולא ירחק היום שהדבר יהיה מקובל גם בהפרעות קצב לב מורכבות יותר כמו פירפור פרוזדורים -עם ההתפתחויות הטכנולוגיות פעולות אלו הופכות להיות פשוטות יותר ,בטוחות יותר ומוצלחות יותר .
ד"ר רון סלע
מנהל היחידה לאלקטרופיזיולוגיה וקוצבים
מרכז הרפואי לגליל
הפקולטה לרפואה בצפת, אוניברסיטת בר-אילן.